本文引用著录格式:孙丽君,王爱玲,张福杰,等。HIV阳性孕产妇全程管理专家共识[J].中国艾滋病性病,2020,26(3):335-336,封三,封四.
DOI:10.13419/j.cnki.aids.2020.03.31
孙丽君1,王爱玲2,张福杰3,吴昊1,赵红心3,王辉4,王前2,王敏5,刘水青6,宋玉霞7,陈耀凯8,庞俊9,赵清霞10,喻剑华11,蔡琳12,李凌华13,何浩岚13,李在村1,黄晓婕1,张宏伟1,刘安1,蔡卫平13
(1.首都医科大学附属北京佑安医院,北京 100069;2.中国疾病预防控制中心妇幼保健中心,北京 100101;3. 首都医科大学附属北京地坛医院,北京 100015;4.深圳市第三人民医院,广东 深圳 518000;5.长沙市第一医院,长沙 421001;6. 贵阳市公共卫生救治中心,贵阳 550004;7.新疆维吾尔自治区第六人民医院,乌鲁木齐 830013;8.重庆市公共卫生医疗救治中心,重庆 400036);9. 南宁市第四人民医院,南宁530023;10.郑州市第六人民医院,郑州 450015;11.杭州市西溪医院,杭州 310023;12.成都市公共卫生临床医疗中心,成都 610000;13.广州市第八人民医院,广州 501160)
摘要:艾滋病是全球一个严重的公共卫生问题,做好艾滋病病毒(HIV)阳性孕产妇的管理工作,有助于减少新生儿HIV感染的风险,提高母亲和婴儿的健康水平。本共识规范了HIV阳性孕产妇的全程管理,在孕前咨询和保健,妊娠期、分娩期和产后的管理方面具有指导作用。
关键词:艾滋病病毒;孕产妇管理;母婴传播;共识
尽管抗病毒治疗(ART)可抑制艾滋病病毒(HIV)复制,减少HIV传播,但艾滋病仍然是全球一个严重的公共卫生问题[1]。截至2017年底,全球大约有110万HIV感染的孕产妇,在未经干预的情况下,母婴垂直传播可达15%~45%[2]。随着妊娠期间HIV筛查、对HIV感染孕产妇进行ART。我国自2015年起在全国全面开展预防艾滋病及避免母乳喂养等综合措施的实施,HIV围生期传播率可下降到1%以下[3-4]。我国自2001年开始开展预防艾滋病母婴传播工作,2015年起在全国开展预防艾滋病母婴传播工作。预防HIV母婴传播应该综合考虑3个原则[5]: 1)降低HIV母婴传播率; 2)提高婴儿健康水平和婴儿存活率; 3)关注母亲及所生儿童的健康。HIV阳性孕产妇全程管理包括孕前咨询和保健、妊娠期管理、分娩期管理以及产后管理。
1 对HIV感染育龄妇女的孕前咨询和保健
1.1 孕前咨询和保健 在孕前咨询和保健时,应了解育龄妇女的生育意愿,提供有关安全性行为的信息,以减少非意愿妊娠。HIV感染时可以选用多种避孕方法;但在使用激素避孕药时,应考虑与ART药物之间的相互作用。达芦那韦/利托那韦(DRV/r)、福沙那韦/利托那韦(FPV/r)和洛匹那韦/利托那韦(LPV/r)可导致激素的药时曲线下面积(AUC)降低,醋酸甲羟孕酮(DMPA)与ART药物之间不存在明显的相互作用,核苷类反转录酶抑制剂(NRTIs)对激素避孕药没有影响[6]。鼓励戒酒、戒烟,避免滥用药物。
1.2 育龄期妇女的 ART 育龄期妇女往往面临更多心理问题,妊娠期患抑郁症偏高[7]、围生期抑郁症风险可能更高[8]。育龄妇女的心理问题,往往来自身体和认知功能受损、社会经济状况较差、内疚感、害怕将HIV传播给婴儿、担心病情被披露、怀孕前有多个性伴、母亲患有HIV感染对孩子的负面影响、多胎生产以及耻辱感。药物依从性差能使女性更容易出现抑郁[9],同时,更差的抑郁评分也会导致依从性不良[10]。所有计划妊娠的HIV感染妇女都应接受 ART ,即使孕前血浆病毒载量低于检测下限[6]。在选择或评估 ART 时,应考虑到方案的有效性、病人的乙型肝炎病毒(HBV)/丙型肝炎病毒(HCV)合并感染状况、病人依从性、方案中药物的潜在致畸风险,以及对母亲和胎儿可能产生的不良后果。在开始ART前,应充分考虑和评估 ART 方案的精神不良反应,在保证疗效的情况下,选用相对精神不良反应更少、依从性更好的 ART 方案。
1.3 单阳或双阳家庭的生育选择 所谓单阳家庭是指夫妻双方一方感染HIV,而另一方没有感染;而双阳家庭是指夫妻双方均感染HIV。单阳家庭中HIV阴性一方在受孕过程中存在被HIV阳性一方感染HIV的风险。由于生殖道感染可增加HIV感染的风险,孕前应对性伴侣进行生殖道感染筛查和治疗。男阴女阳家庭在女方接受ART且HIV载量已经控制的情况下可选择体外授精。男阳女阴家庭选择捐赠精子人工授精可以完全避免HIV传播的风险,如果不接受捐赠精子,在男方进行 ART 达到持续病毒抑制(血浆HIV病毒载量 <50拷贝/ mL)后,可考虑在排卵期进行自然受孕。这种情况下夫妻间传染的概率极低[6]。文献显示,HIV阳性的男方未达到病毒抑制而试图自然受孕时,建议HIV阴性的女方应在排卵期无套性交前、后各服用替诺福韦(TDF)/恩曲他滨(FTC)或者TDF+拉米夫定(3TC)1个月进行暴露前预防。阳性一方接受ART 且HIV载量达到持续抑制是HIV单阳家庭备孕的关键。如果HIV载量检测受限或不可及的情况下,建议ART半年以上再进行自然受孕[5]。HIV双阳家庭也要双方接受 ART 且HIV病毒载量达到持续抑制的情况下在女方排卵期自然受孕,受孕成功后的处理措施参见本共识“2 HIV阳性孕妇的妊娠期管理”。
2 HIV阳性孕妇的妊娠期管理
2.1 ART 药物方案 无论孕产妇HIV病毒载量或CD4+T淋巴细胞(简称CD4细胞)计数如何,所有HIV感染孕妇应在妊娠期尽早启动ART,以防止母婴传播。在为孕妇选择ART方案时,必须考虑多种因素,包括不良反应、药物相互作用、药代动力学(PK)、单用药物和药物组合的方便性、妊娠期间使用这些药物的经验以及病人的耐药性检测结果和并发症。
HIV阳性孕妇ART方案参见表1。在肌酐清除率 <60mL /min时应避免使用TDF;严重药物毒性、妊娠剧烈呕吐、手术或药物短缺可能导致停药。无论出于任何原因,应同时停用所有抗HIV药物,并在条件允许时尽快重新开始ART。
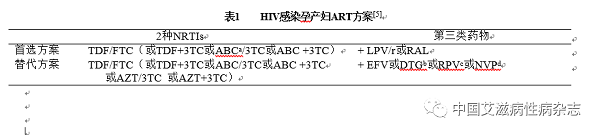
表1 HIV感染孕产妇ART方案[5]
注:TDF:替诺福韦;ABC:阿巴卡韦;3TC:拉米夫定;FTC:恩曲他滨;AZT:齐多夫定;EFV:依非韦伦;LPV/r:洛匹那韦/利托那韦;RAL:拉替拉韦;NVP:奈韦拉平;RPV:利匹韦林;DTG:多替拉韦。
a:用于HLA-B*5701阴性者;b:2019 世界卫生组织指南指出孕期使用DTG预期获益大于风险,如果已充分告知DTG的潜在神经管畸形风险(从受孕时至第一孕期末),可以为有生育需求的女性处方DTG。2019DHHS指南指出不应为下列人群处方DTG:怀孕12周内的孕妇,有生育潜力并计划怀孕的人,有生育潜力、性活跃且不使用有效避孕措施的人。2018 EACS 指南指出,服用DTG的妊娠前3个月的妇女需要将DTG更换为另一种第三类药物;c:RPV仅用于病毒载量 <105拷贝/mL和CD4 细胞>200个 /mm3的病人;d:对于基线CD4 细胞 >250个/μL的病人要尽量避免使用含NVP的治疗方案,合并丙型肝炎病毒感染的避免使用含NVP的方案。
2.2 孕晚期启动的ART 孕晚期 ART 的目标,是尽可能快速降低孕妇的HIV病毒载量,尽量确保分娩时HIV病毒载量维持在检测不到的水平,以减少母婴传播的风险。如果女性病人发现较晚,于妊娠的中期或晚期发现,应立即启动ART,可优先选择含整合酶抑制剂的 ART 方案,以尽快降低HIV病毒载量,确保HIV病毒载量在分娩时期检测不到。如果女性病人的HIV病毒载量在妊娠晚期仍然可以测到,实施耐药测试,如果尚未使用整合酶抑制剂的话,可考虑改为或增加整合酶抑制剂(RAL或DTG),以达到HIV病毒载量的快速下降[11]。
2.3 妊娠期间对孕妇和胎儿的监测 HIV感染妇女血浆HIV 核糖核酸(RNA)监测包括产前监测、启动ART或改变ART方案后2至4周、然后每月监测1次直至 <50拷贝/mL [6];在妊娠期间每3个月监测一次。此外,在妊娠约34至36周时检测HIV病毒载量水平,以便决定分娩方式以及新生儿预防方案[12]。
应在初次产前检查时监测CD4 细胞计数,对于ART ≥2年的病人,如果病毒持续抑制且CD4 细胞计数一直>300/mm3,妊娠期间不必重复CD4 细胞监测。ART <2年、CD4 细胞为< 300/mm3,以及依从性不佳和/或可检测到HIV病毒载量的妇女,在妊娠期间应每隔3~6个月检测一次CD4 细胞计数。
对于HIV病毒载量超过耐药性检测阈值(即500~1 000拷贝/mL )的妇女,应在启动 ART 或病毒学失败时进行HIV耐药检测。在耐药检测结果回报之前启动ART,然后根据耐药结果调整ART药物[6]。
妊娠期间ART 药物并发症的监测基于孕妇正在服用药物的不良反应。正在使用ART,尤其是用蛋白酶抑制剂的孕妇应监测血糖。HIV感染孕妇中胎儿的监测与HIV未感染的孕妇相同。
2.4 HIV合并HBV或HCV感染孕产妇 在怀孕期间,所有HIV感染孕妇都应接受HBV和HCV感染筛查,除非已知现症感染。所有HIV感染而乙肝五项阴性的孕妇应接种HBV疫苗。HBV/HIV合并感染妇女的ART应包括TDF+3TC(或FTC)。如果正在接受包含TAF的ART方案且HIV被抑制,孕妇可以选择继续使用或将TAF换为TDF。HIV合并HBV或HCV共感染的妇女在开始ART后1个月应检测肝功能,随后妊娠期间至少每月评估一次。出生后12小时内,HBV感染妇女所生的婴儿应接受乙肝免疫球蛋白和第一剂HBV疫苗[13]。HCV/HIV合并感染的妇女所生婴儿应进行HCV感染评估。
3 分娩期管理
3.1 分娩时ART与预防 分娩前已接受ART的孕妇应在分娩期间或择期剖宫产术前尽可能按原方案继续治疗。孕妇血中HIV病毒载量>1 000 拷贝/mL 或HIV病毒载量未明者应于临产前给予表1中ART方案。HIV 病毒载量介于50~999 拷贝/mL 的孕妇可考虑给予表1中ART方案。原已接受ART、依从性好且孕晚期和临产前血中HIV病毒 载量<50 拷贝/mL 的孕妇继续原来的方案治疗[14]。
HIV感染状态未明的临产妇应进行HIV快速检测及抗原/抗体联合免疫检测。筛查结果“待复查”时需尽快进行补充试验(HIV抗体确证实验和核酸检测),在等待补充试验结果的同时,及时给予产妇ART或进行新生儿ART预防。筛查结果“待复查”的产妇在不能完全排除HIV感染可能时,应停止哺乳。如果HIV抗体确证试验阴性且HIV核酸检测阴性,排除急性期感染可能,应停止预防母婴传播的抗HIV药物。
3.2 母婴传播与分娩方式 HIV感染不作为实施剖宫产的指征。
对于临产前HIV病毒载量> 1 000 拷贝/mL ,无论孕期是否接受过ART,建议在妊娠38周时进行择期剖宫产以尽量减少母婴传播[15]。对于孕期接受ART且临产前HIV RNA≤1 000 拷贝/mL 的孕产妇,建议阴道分娩,如果需要进行剖宫产或引产,应按照产科适应证的标准进行。
值得注意的是,HIV病毒载量>1 000 拷贝/mL 或病毒载量未知且产程自然发动或胎膜破裂的孕产妇,没有足够证据确定剖宫产会降低围生期HIV传播的风险。
3.3 其他分娩时管理注意事项 正在接受ART且达到病毒学抑制的孕产妇可以根据标准产科指征进行人工破膜术[6]。由于可能增加HIV围生期传播的风险,除非有明确的产科指征,一般应避免常规使用胎儿头皮电极进行胎儿监护以及使用产钳或负压吸引器进行手术分娩。
在处理子宫弛缓症导致的产后出血过多时,如果产妇正在接受细胞色素P450 (CYP) 3A4酶抑制剂(例如蛋白酶抑制剂)、整合酶抑制剂、考比司他,只有在无其他替代方法,收益大于风险时,才考虑使用甲炔诺酮,并以最低有效剂量短时间内给药;如果产妇正在接受CYP3A4酶诱导剂(如奈韦拉平或依非韦伦)治疗,由于这些药物可导致甲基麦角新碱浓度和疗效降低,应加用其他缩宫剂[6]。
4 产后管理
4.1 产妇管理 HIV感染产妇产后必须继续ART,不可停药或减量;如原方案已达到病毒学抑制,一般不需要更改治疗方案。
4.2 新生儿预防用药 HIV感染母亲所生儿童应在出生后尽早(6~12 h内)使用抗病毒药物。对于母亲已接受ART,依从性较好且达到持续病毒学抑制者,可给予4周AZT或NVP进行预防;对于孕期ART没有达到持续病毒学抑制、治疗不满4周或产时才发现HIV感染的孕产妇所生儿童应使用AZT或NVP 6周,具体详见“预防艾滋病、梅毒和乙型肝炎母婴传播工作实施方案(2015年版)”[16]。对于孕期未接受ART且急产的孕产妇所生新生儿,国内外共识是应用三联药物ART,三联方案可选用AZT或ABC+3TC+LPV/r(无2周内的适应证)或NVP或EFV(但是一定要配备相关的感染科和儿科医生,承担儿童并发症的诊疗)。
为了预防耶氏肺孢子菌肺炎(PCP),所有HIV感染母亲所生的婴儿在完成4~6周HIV预防治疗后应进行PCP预防,除非已排除HIV感染。
4.3 产后喂养指导 应当对HIV感染孕产妇所生儿童提倡人工喂养,避免母乳喂养。医务人员应当针对HIV感染孕产妇及其家人就人工喂养环境与条件、可接受性、知识和技能、可及性,可持续获得足量、营养和安全的代乳品等情况,及时进行综合的喂养指导和科学喂养评估。对于具备人工喂养条件者尽量提供人工喂养,并给予指导和支持。
对于因不具备人工喂养条件而选择母乳喂养的HIV感染产妇及其家人,指导其坚持正确的纯母乳喂养,喂养时间最好不超过6个月。母乳喂养期间,HIV感染产妇应坚持ART,产妇乳腺炎和婴儿鹅口疮会增加母乳喂养HIV传播的风险,应及时识别和治疗。在母乳喂养期间婴儿每3个月进行一次病原学检测,在停止母乳喂养后4~6周、3个月和6个月进行随访检测。一旦发生HIV感染,迅速为婴儿启动ART。
4.4 HIV阳性孕妇所生儿童的随访 HIV感染产妇所生婴儿应在出生时(48h)、6周以及3个月进行HIV核酸检测,以便早期诊断。HIV抗体检测在出生后12个月和18个月进行[5]。核酸检测阴性而18个月时抗体阳性的HIV暴露儿童应每隔3~6个月检测HIV抗体,直至抗体转阴。为了检测服用预防感染药物的安全性,出生后需进行血常规及肝功能检查作为基线评估的依据,之后监测的时间间隔取决于基线时肝功能和血常规的数值、孕龄、新生儿的临床状况、AZT或NVP的剂量,以及其他药物的使用情况。
应为HIV感染孕产妇所生儿童提供常规保健、生长发育监测、感染状况监测、预防营养不良指导、免疫接种、艾滋病检测(包括抗体检测和早期核酸检测)等服务。
4.5 婴幼儿HIV感染的诊断 围生期和产后HIV暴露的婴儿和18个月以下儿童的HIV诊断必须使用直接检测HIV的病毒学方法,包括HIV RNA和HIV 脱氧核糖核酸(DNA)核酸检测(NATs)。对于围生期HIV传播风险较高的婴儿,建议在出生时和停止预防性ART后2~4周进行病毒学检测。18月龄及以下儿童,符合下列一项者即可诊断[5]: 1)为HIV阳性母亲所生且HIV检测结果阳性; 2)为HIV感染母亲所生和两次HIV核酸检测均为阳性(第二次检测需在出生6周后进行); 3)有医源性暴露史,HIV分离试验结果阳性或两次HIV核酸检测均为阳性。
非母乳喂养的婴儿基于两次或多次病毒学检测阴性可明确排除HIV感染[17]:一次在≥1个月时检测,另一次在≥4个月时检测。或者根据≥6个月的两次不同样本中检测HIV抗体阴性来排除HIV感染。或者按照国内推荐,根据两次病毒学检测(一次在出生6周,另一次在出生3个月)阴性排除婴儿HIV感染。由于围生期HIV暴露的儿童18~24个月时偶尔会有残留的母亲HIV抗体[18],因此HIV抗体呈阳性的这一年龄组儿童应该基于HIV核酸检测排除或确认HIV感染。非围生期暴露的儿童或年龄超过24个月的围生期暴露儿童主要依赖于HIV抗体(或抗原/抗体)检测进行诊断;当怀疑有急性HIV感染时,需要加用HIV核酸检测进行诊断。
如果根据 2 次核酸检测来诊断或者排除婴儿HIV感染,必须在出生18~24个月进行HIV抗体检测来证实。











 2020
2020