抗血栓药物治疗在妇产科及生殖领域日益受到重视,尤其在复发性流产(recurrent spontaneous abortion,RSA)合并血栓前状态(prethrombotic state,PTS)的治疗中应用越来越广泛。但如何选择和使用抗血栓药物尚无规范和标准。为此,我们组织国内多位相关领域专家结合国内外最新研究证据和进展,共同讨论制定本共识。本共识旨在进一步规范RSA患者抗血栓药物使用,为临床医师在临床实践中做出合理判断提供决策依据。
复发性流产抗血栓药物治疗中国专家共识
本文刊登于《中华生殖与避孕杂志》2022, 42(12): 1207-1217.
DOI: 10.3760/cma.j.cn101441-20220907-00385
作者:国家妇幼健康研究会生殖免疫学专业委员会专家共识编写组
通信作者:
赵爱民
Email:Zamzkh0526@126.com
电话:+86-21-68383064
韦相才
Email:Dxcwei@163.com
电话:+86-20-39151663
前言
复发性流产(recurrent spontaneous abortion,RSA)的定义目前尚存争议,主要集中在流产孕周、流产次数、流产是否连续发生以及是否包含生化妊娠等方面。欧洲人类生殖与胚胎学会(European Society of Human Reproduction and Embryolgy,ESHRE)[1]、美国生殖医学学会(American Society for Reproductive Medicine,ASRM)[2]和英国皇家妇产科医师协会(Royal College of Obstetricians and Gynaecologists,RCOG)[3]有关指南中更强调的是“反复妊娠丢失(recurrent pregnancy loss,RPL)”的概念。本共识采用《自然流产诊治中国专家共识2020版》中关于RSA的定义:将连续发生2次及以上妊娠28周前的胚胎丢失定义为RSA,包括生化妊娠[4-5]。RSA病因复杂多样,主要包括染色体及基因(父母及胚胎)异常、女性生殖道解剖结构异常、内分泌异常、母体免疫学异常及血栓前状态(prethrombotic state,PTS)[6]。研究表明PTS与RSA等不良妊娠结局存在密切关联(推荐级别B,证据水平3b)[7-11]。PTS根据病因分为遗传性和获得性两大类[12]。遗传性PTS是指各种基因缺陷导致易于发生血栓的一类遗传性疾病,包括凝血因子缺陷或基因突变、抗凝蛋白缺陷、异常纤维蛋白血症、遗传性高同型半胱氨酸血症(heredity hyperhomocysteinemia,HHcy)等;获得性PTS主要包括抗磷脂综合征(antiphospholipid syndrome,APS)和获得性高同型半胱氨酸血症(acquired hyperhomocysteinemia,AHHcy)以及其他引起血液高凝状态的疾病[13]。研究表明PTS与RSA尤其是妊娠中晚期胎儿丢失以及与深静脉血栓的发生存在密切关联(推荐级别B,证据水平3b)[14]。PTS导致RSA的机制主要是胎儿胎盘微循环障碍及其产生的一系列继发病理改变[15-16]。基于PTS的病理机制,抗血栓治疗被认为是RSA合并PTS有效的治疗方法。然而,如何规范使用抗血栓药物,比如在药物选择、剂量调整、使用抗血栓药物起始时间、持续时间、是否联合用药以及如何进行疗效监测等方面都有待进一步规范。临床实践中,抗血栓药物应用不规范现象,包括过度治疗、超适应证用药以及超剂量使用情况普遍存在。为进一步规范RSA患者抗血栓治疗方案,国家妇幼健康研究会生殖免疫学专业委员会在2021年《复发性流产合并血栓前状态诊治中国专家共识》[17]的基础上,再次组织国内生殖免疫学、生殖医学、妇产科学、风湿免疫学、血液病学、检验医学以及循证医学专家,结合国内外最新的研究证据和进展,共同讨论制定本共识。本共识旨在为临床医师在临床实践中做出合理判断提供参考。
共识编写组对数据库中截至2022年8月1日的文献进行检索和初筛,对于通过初步筛选的文献进行了全文的阅读和二次筛选,尤其深入讨论了国内外已发表的相关指南和共识。检索的中文数据库包括中国知网、清华同方、万方数据库、维普中文科技期刊数据库,中文文献检索使用的关键词为“复发性流产”“反复性流产”“习惯性流产”和“反复妊娠丢失”。检索的英文数据库包括:PubMed、Web of Science、Embase、the Cochrane Database和Scopus,英文文献检索使用的关键词或医学主题词:“pregnancy”“abortion” “miscarriage” “habitual”“recurrent pregnancy loss”“thromboembolism” “thromboprophylaxis” 等。本专家共识根据英国牛津大学循证医学中心制定的证据分级和推荐强度标准[18],研究证据分级由2名小组成员分别独立进行,对于有争议的问题,提交共识小组进行讨论。
一、抗血栓治疗适应证
1、RSA合并以下情况为抗血栓治疗的绝对适应证
①遗传性PTS,中国汉族人群常见的有蛋白C(protein C,PC)、蛋白S (protein S,PS)、抗凝血酶(antithrombin,AT)和血栓调节蛋白(thrombomodulin,TM)等基因缺陷导致的血栓前状态;
②APS;③静脉血栓栓塞(venous thromboembolism,VTE)病史或VTE患者;
④高危型系统性红斑狼疮(systemic lupus erythematosus,SLE)等自身免疫疾病;
⑤长期卧床,VTE风险评分较高者[19-21];
⑥较大手术如髋关节、脊髓手术、恶性肿瘤手术等。
2. RSA合并以下情况为抗血栓治疗的相对适应证
①自身免疫性疾病,如未分化结缔组织病(undifferentiated connective tissue disease,UCTD);
②内科合并症,如高血压、糖尿病、慢性肾病及高脂血症等[22-23];
③合并恶性肿瘤;
④化疗;
⑤长期静脉置管等[24-25];
⑥其他免疫紊乱异常合并凝血功能障碍。
二、常用抗凝药物
1、普通肝素(unfractioned heparin,UFH)
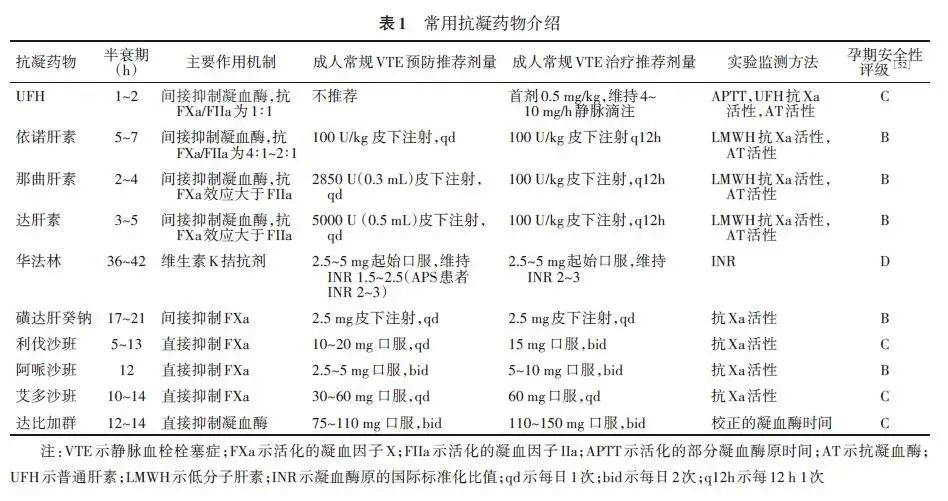
UFH是从猪肠黏膜或牛肺等动物组织中提取精制的一种硫酸氨基葡聚糖混合物,相对分子质量范围3 000 000~30 000 000 [26],其中只有相对分子质量较低的组分才有较强的抗凝作用。UFH主要通过与AT结合而间接发挥抗凝作用,其对FIIa与FXa活性具有同等的抑制能力,UFH抗FXa/FIIa为1:1。除了抑制FXa、FIIa活性外,UFH还可抑制FIXa与FXIa的活性。UFH需静脉滴注,其血浆半衰期为1~2 h [27]。一般在停药后4~6 h凝血功能恢复正常。UFH大多经网状内皮细胞系统清除降解,少量经肾脏排泄,UFH不能通过胎盘屏障[27]。UFH主要用于VTE的防治(推荐级别D,证据水平5)。
2、低分子肝素(low molecular weight heparin,LMWH)
LMWH是UFH经过一定方法裂解后的硫酸葡萄糖胺聚糖链的混合物,相对分子质量相对较小,一般相对分子质量范围3 000 000~6 500 000[28]。LMWH的抗FXa/FIIa为4:1~2:1或更高,相较于UFH,由于保留了部分FIIa活性,LMWH具有抗凝效果好、出血风险小等优势。此外,体外研究显示,LMWH还具有抑制抗磷脂抗体谱(antiphospholipid antibodies,aPLs)免疫反应、保护血管内皮以及抑制滋养细胞凋亡等生物学作用[29-31]。
LMWH血浆半衰期为3~7 h(不同种类LMWH半衰期不同),一般在停药后12~24 h凝血功能恢复正常[31]。LMWH皮下注射生物利用度高,达90%以上,主要经肾脏排泄,相对分子质量较大者还可经网状内皮系统清除。因此,肾功能不全者使用LMWH时可能发生药物在体内蓄积,应进行抗Xa活性监测并及时调整剂量,同时可选择相对分子质量较大的LMWH,以减轻肾脏负担[33]。LMWH同UFH一样不能通过胎盘屏障,也主要用于VTE的防治。LMWH目前为妊娠期抗凝治疗的首选药物(推荐级别A,证据水平1b)。
3、磺达肝癸钠
磺达肝癸钠是第一个人工合成的选择性FXa抑制剂,不含来源于动物的成分[34-35],相对分子质量为1 700 000。磺达肝癸钠以1:1的比例与AT上的戊糖结构结合而抑制因子FXa活性,但这种结合是可逆的,当磺达肝癸钠活化一个分子的AT后,便以原型释放并结合其他的AT分子,使AT抑制因子FXa的速率增加约300倍而发挥间接的抗凝作用。但磺达肝癸钠并不影响AT对凝血酶的抑制,与血小板也无相互作用。生物利用度极高(100%),半衰期17~21 h,不经过肝脏代谢,大多以原形形式经肾脏排泄[35],故禁用于肌酐清除率<20 mL/min的严重肾功能不全者。
磺达肝癸钠由于相对分子质量较小,可少量通过胎盘,其出血风险与LMWH相当,一般预防剂量不需要常规实验室监测,极少诱发血小板减少,剂量固定,治疗窗较宽,主要用于VTE的防治[36],尤其是骨关节、脊髓大手术围手术期VTE的防治[37-38]。考虑到胎儿的安全性不作为首选,但在下列情况下可选择磺达肝癸钠替代UFH或LMWH(推荐级别D,证据水平5):①使用UFH或LMWH出现中到重度的肝功能受损;②出现了肝素诱导的血小板减少症(heparin-induced thrombocytopenia,HIT);③出现较大的绒毛膜下血肿[39-42]。
4、维生素K拮抗剂
以华法林为代表,华法林为间接多靶点作用抗凝药,可通过抑制维生素K依赖的凝血因子(II、VII、IX与X)的活性而发挥抗凝作用。华法林起效较慢,半衰期长,易受药物及食物影响[43]。单独应用时由于要首先耗竭依赖维生素K的凝血因子才开始起作用,如需快速发挥抗凝效果应与肝素类或新型口服抗凝药重叠给药一段时间后才可发挥稳定的抗凝效果。
因个体差异较大,使用华法林时需要定期监测国际标准化比值(international normalized ratio,INR)。通常治疗性抗凝强度建议将INR控制在2.0~3.0之间,预防性抗凝建议将INR控制在1.5~2.5之间。华法林是非孕期长期抗凝治疗的常用药,但可通过胎盘屏障,妊娠早期应用可造成“胎儿华法林综合征”[44],因此,妊娠早期应避免使用,妊娠中晚期如不能耐受其他抗凝药物或其他抗凝药物无效(如AT缺陷,可产生肝素抵抗)可考虑使用华法林 (推荐级别B,证据水平2b)[45]。
5、新型口服抗凝药
包括沙班类和达比加群酯等。沙班类(如利伐沙班、艾多沙班、阿哌沙班等)为口服的FXa直接抑制剂,不依赖抗凝血酶,可直接与FXa活性部位结合,起效迅速,达峰浓度一般为2~4 h,生物利用度高(80%~100%),半衰期为5~9 h,其中约2/3在肝脏代谢,1/3通过肾脏清除[46]。达比加群酯是口服的单靶点直接抗凝血酶抑制剂,其前体药物进入体内被酯酶水解后生成达比加群而发挥抗凝作用,达峰时间为0.5~2 h,半衰期为12~14 h,多以原型通过肾脏排泄,故对于高龄者以及肾功能不全者应谨慎使用。
近年来,由于新型口服抗凝药起效快且安全范围较宽,出血的危险性相对较低,使用方便,一般不需要按体质量调整剂量,在非孕期的血栓栓塞性疾病的防治中得到广泛应用。但在妊娠/哺乳期的安全性尚未明确,故不推荐在妊娠期和哺乳期使用[47](推荐级别D,证据水平5)。表1为各种常用抗凝药物的主要作用机制、半衰期、成人VTE的常规预防和治疗剂量以及实验室监测方法[48-51]。
三、常用抗血小板药物
1、阿司匹林或乙酰水杨酸(aspirin or acety lsalicylic acid,ASA)
ASA作为血栓烷A2抑制剂仍是应用最广泛的抗血小板药物。ASA不可逆地抑制环氧化酶(cycloxygenase,COX)-1和COX-2合成,减少血栓烷A2的生成从而抑制血小板聚集功能。低剂量ASA(low-dose aspirin,LDA,50~100 mg/d)可明显抑制COX-1,降低TXA2,而不影响前列环素的产生;高剂量ASA可同时抑制COX-1和COX-2,抑制所有前列腺素的产生[53]。研究显示ASA还具有扩张血管、改善子宫局部血液动力学、改善子宫内膜容受性的作用,被广泛应用于生殖医学领域,如子痫前期的防治、RSA合并PTS、APS、SLE的防治等,可显著改善妊娠结局[54-58],且安全性好。
2、腺苷二磷酸(adenosine diphosphate,ADP)受体抑制剂
ADP受体抑制剂如氯吡格雷等主要作用于血小板P2Y12受体,通过选择性抑制ADP与血小板受体的结合及抑制ADP介导的糖蛋白GPⅡb/Ⅲa复合物的活化而抑制血小板聚集。对血小板ADP受体的作用是不可逆的。口服吸收迅速,与血浆蛋白结合率为98%,通过肝脏代谢,主要代谢产物无抗血小板聚集作用[59]。ADP受体抑制剂的抗血栓效果已被大量的临床资料证实,联合应用ASA与氯吡格雷可长期获益,总体安全性和耐受性良好。
氯吡格雷联合LDA对APS有显著疗效。Islam等[60]对81例伴有动脉血栓的APS患者进行了单中心回顾性研究,结果显示54%的患者应用氯吡格雷联合LDA可预防动脉血栓的复发。美国食品药品监督管理局(Food and Drug Administration, FDA)将氯吡格雷定为妊娠期B类药。研究表明氯吡格雷可通过乳汁分泌,在动物试验中无证据表明氯吡格雷具有胚胎毒性,在人类妊娠期和哺乳期应用的相关资料较少,目前尚无氯吡格雷在RSA患者中的相关研究报道,在患者不能耐受ASA或出现ASA抵抗时可用氯吡格雷替代[61-64]。
四、常用抗血栓治疗方案
1、一线治疗
抗凝治疗首选LMWH(推荐级别A,证据水平1b),抗血小板治疗首选ASA(推荐级别B,证据水平2b)[20,65]。ASA一般选择低剂量(LDA),50~100 mg/d。表2中为常用抗血栓治疗方案总结。

(1)遗传性PTS
除遗传性HHcy以外,遗传性PTS多形成静脉血栓,治疗以抗凝为主,可以单用或联合ASA治疗。确诊合并遗传性PTS的RSA患者,再次妊娠前要进行VTE风险评估,并制定个体化的防治方案。对于正在发作的VTE,应列为妊娠禁忌证,需经相关学科积极治疗,治愈6个月以上方可妊娠,妊娠后继续使用治疗剂量LMWH,产后至少使用4~6周(推荐级别B, 证据水平2a)[20];对于有VTE病史的RSA患者,一旦妊娠要立即给予治疗剂量LMWH,直至产后4~6周(推荐级别B,证据水平2b);对于无VTE病史的RSA合并遗传性PTS患者,应有计划妊娠,一旦妊娠确诊,即开始给予预防剂量的LMWH,并持续整个孕期,产后至少使用2~4周(推荐级别B,证据水平2b)。如合并血小板激活表现,可联合LDA治疗。
(2)获得性PTS
由于获得性PTS不同于遗传性PTS,既可以形成静脉血栓,也可以有动脉血栓形成,因此,抗血栓治疗通常为联合使用LMWH和LDA(推荐级别B,证据水平2b)。
2、二线治疗
二线抗栓药物有磺达肝癸钠、华法林等抗凝药物和抗血小板药物氯吡格雷。磺达肝癸钠相对分子质量较小,可少量通过胎盘屏障[66],虽然目前FDA推荐为妊娠B类药物[52],但考虑到胎儿的安全性,不推荐磺达肝癸钠作为妊娠期一线用药(推荐级别D,证据水平5)。同时,因其有高效的抗凝效果和较长的半衰期,在无计划的情况下分娩启动或急症手术时,会增加出血的风险。因此,只用在LMWH不能耐受或无效的情况下才推荐使用。
通常不建议孕期使用华法林,尤其是妊娠早期[45]。但对于应用肝素类药物无效的患者(如遗传性AT缺陷症、异常凝血酶原血症对肝素天然抵抗)[67]或换机械性心脏瓣膜的妊娠妇女,鉴于血栓形成的高风险,也可考虑使用华法林[68]。氯吡格雷作为ADP受体的拮抗剂可用于替代ASA进行抗血小板治疗,目前妊娠期应用氯吡格雷资料较少,需要积累更多的临床资料[63-69]。
五、抗血栓治疗效果监测
1、LMWH
LMWH使用效果主要通过抗Xa活性的高低来判断。一般情况下,不需要常规监测抗Xa活性 (推荐级别D,证据水平5),但由于存在个体差异,仍存在抗凝过度或不足的风险。因此对特殊人群,如体质量过轻(≤45 kg)、体质量过大(≥80 kg)、肾功能不全以及有出血倾向者等,应定期监测抗Xa活性,可依据抗Xa活性调整LMWH剂量,避免剂量过量或不足。在肌酐清除率<30 mL/min时,应慎用LMWH[70]。对于 LMWH不能耐受或发生HIT的患者,停用肝素类抗凝药物,可选择磺达肝癸钠或非肝素类药物。
2、磺达肝癸钠
磺达肝癸钠是人工合成的选择性Xa因子抑制剂,对IIa因子以及血小板无抑制作用,与LMWH一样,主要通过抗Xa活性的高低来判断其使用效果[36]。
3、华法林
使用华法林主要通过监测INR来判断其抗凝效果。INR一般应控制在2.0~2.5之间。开始用药时每周检测1~2次,根据INR值调整药量,当INR达到治疗目标范围且稳定时,可改为每月检测1次[71]。妊娠期没有合并瓣膜血栓问题,禁用华法林以避免胎儿畸形、出血、死胎等风险,哺乳期华法林与蛋白结合,也很少从乳汁中分泌,不影响哺乳,可选择口服华法林[72]。既往有血栓史,在妊娠前就开始用肝素或LMWH抗凝治疗,在妊娠期不用华法林,因产后3个月内发生血栓风险极大,故产后应继续抗凝治疗6~12周;可以在产后2~3周内可把肝素改为华法林。华法林原研药品说明书中未限制肝功能不全患者用药,但国产药品均将肝功能不全列为华法林的禁忌证。
4、ASA
可通过花生四烯酸(arachidonic acid,AA)诱导的血小板聚集率(platelet aggregation test,PagT)或血栓弹力图(thrombelastography,TEG)最大振幅 (maximum amplitude,MA)值及血小板AA图来判断使用ASA效果。一般情况下服用ASA后,AA诱导的血小板PagT快速下降,甚至降至0。通常将PagT(AA)控制在0~20%较为理想,TEG MA值一般控制在30~65 mm范围。如果TEG MA值<30 mm,则有出血风险。
临床上可根据PagT(AA)来调整ASA用量,妊娠期一般使用LDA(50~100 mg/d)。如果剂量达到100 mg/d,PagT(AA)仍然没有达到治疗目标范围,要考虑患者可能存在ASA抵抗,可通过TEG-AA进一步确认患者是否存在ASA抵抗。一般AA抑制率<30%,认为ASA无效,AA抑制率30%~50%为不敏感,50%~75%为起效,>75%认为血小板被明显抑制。如果存在ASA抵抗,建议使用氯吡格雷替代[61]。因目前尚缺乏氯吡格雷对胎儿的安全性及有效性的支持证据,妊娠期应慎用氯吡格雷等其他类型抗血小板药物作为替代。
5、氯吡格雷
可通过ADP诱导的PagT或TEG MA值及血小板ADP图来判断使用氯吡格雷效果。通常将PagT(ADP)控制在30%~50%较为理想,如果PagT(ADP)控制不理想,也要考虑患者可能存在氯吡格雷抵抗,也可通过TEG-ADP进一步确认[62]。ADP抑制率<50%,认为氯吡格雷无效,ADP抑制率50%~90%为起效,>90%认为血小板被明显抑制,出血风险增加。
六、抗血栓治疗常见不良反应和处理
1、出血
出血是抗血小板和抗凝治疗最常见的不良反应,严重者可致残甚至危及患者生命。常见的出血有皮下瘀血、鼻出血、口腔黏膜出血、牙龈出血、眼球结膜出血、消化道出血、膀胱出血、阴道出血等,在抗栓治疗前应详细询问病史,评估出血风险。
出血的高危因素包括:①有活动性出血或大出血病史;②有遗传性或获得性出血性疾病;③肝功能不全;③严重肾功能不全[GFR<30 mL/(min·m2)];④未控制的高血压;⑤血小板减少症 (PLT<50×109/L);⑥活动性消化性溃疡;⑦合并使用非甾体类抗炎药 (nonsteroidal antiinflammatory drugs,NSAID)类药物等。
治疗前应重点询问有无上述病史。治疗过程中应密切观察患者有无出血倾向。重点观察口腔黏膜、牙龈、球结膜、皮肤、大便和小便颜色及性状以及有无阴道出血等,要定期监测凝血,肝肾功能等,建议每2~4周监测PagT、血小板计数、凝血功能、D-二聚体及肝肾功能。如出现凝血功能异常伴明显出血,应及时减量或停用抗栓药物,并根据出血的严重程度、部位、出血量和停药时间判断是否需要给予拮抗剂(如鱼精蛋白、vitK)或补充新鲜血浆、凝血酶原复合物等,也可根据TEG结果进行成分输血,纠正凝血功能[73]。
2、HIT
HIT是在使用肝素类药物后出现的抗体介导的免疫反应,表现为血小板减少、动静脉血栓形成,严重者可致残甚至死亡[66]。在使用UFH人群中常见,LMWH罕见。HIT确切的发病率尚不清楚,美国胸科协会汇总的数据为0.1%~5%[74]。由于HIT是使用肝素类抗凝剂的严重并发症,故在治疗过程中应定期监测血小板计数,如发现血小板减少,特别是较基础水平下降1/3以上者,要充分考虑HIT的可能。可依据HIT 4T’s评分法[75],结合血小板计数动态监测+HIT抗体监测进行综合评估。
4T’s评分法是根据血小板减少的数量特征、血小板减少的时间特征、血栓形成的类型、是否存在其他导致血小板减少的原因等四个要素进行评估的一种简易方法。如≤3分为HIT低度可能,4~5分为HIT中度可能,6~8分为HIT高度可能。中、高度怀疑者,可进行HIT抗体检测以进一步确诊是否为HIT。高度怀疑HIT或一经确诊应立即停用肝素类药物,并采用非肝素类药物进行替代治疗。研究显示,如果单纯停药而不进行非肝素类药物替代抗凝,患者在停药30 d内发生血栓风险为17%或更高[76]。妊娠期常用替代药物包括磺达肝癸钠、华法林等,谨慎使用阿加曲班、比伐卢定等替代[76]。
3、肝脏损害
肝脏损害是LMWH常见的不良反应,发生率为4%~13%[77]。大部分患者在使用LMWH 4~8 d后出现无症状的谷草转氨酶(aspartate aminotransferase,AST)和/或谷丙转氨酶(alanine aminotransferase,ALT)升高,通常在7~10 d内达到峰值,可达正常上限的3倍或更高;持续4~20 d后,部分患者即使继续治疗也会消退。
Dukes等[78]的研究前瞻性观察了86例使用肝素的患者,平均每日剂量为(3.05±0.24)×104 U,治疗持续时间为(7.8±0.4)d。59%的患者在肝素治疗期间出现ALT升高,27%的患者出现AST升高,ALT平均增加3.6倍,AST平均增加3.1倍,AST和/或ALT升高与肝素来源无关,但与使用剂量有关(推荐级别B,证据水平3b)。Monreal等[79]的随机对照试验(randomized controlled trial,RCT)研究观察了接受肝素治疗的158例静脉血栓形成的患者,43例患者接受了低剂量的LMWH(5000 U皮下注射/24 h),共使用10 d,仅仅只有1例患者出现ALT升高。结果显示短期使用低剂量的LMWH并不引起肝功能损害(推荐级别B,证据水平3b)。
Yang等[80]基于回顾性队列评估了LMWH和磺达肝素对肺栓塞患者肝功能的影响。纳入463例接受LMWH(依诺肝素钠或那屈肝素钙)或磺达肝素钠治疗的肺栓塞患者。17.1%的患者存在肝功能障碍,表现为无症状的血清转氨酶水平升高。该研究结果显示,那屈肝素钙的肝功能障碍风险最高,约为依诺肝素钠的2.2倍(95% CI=1.17~4.22;P=0.015)(推荐级别B,证据水平2b)。
因而,在使用LMWH过程中,应定期监测肝功能。一旦发现肝脏损害,应排除病毒性肝炎。如为轻度,不必停用LMWH;一旦出现中重度肝脏损害,则应停用LMWH,改用其他相对分子质量相对较低的LMWH,或其他抗凝药进行替代,同时进行保肝治疗。常用替代药物为磺达肝癸钠。
4、肾功能损害
注射肝素类抗凝剂导致肾功能损害罕见。上海交通大学医学院附属仁济医院观察了妊娠期使用LMWH肾功能损害的发生率,结果未显示达肝素组有肾功能受损,依诺肝素为0.88%、那曲肝素为0.66%[76]。肾功能不全者如出现轻度肾功能损害,不必停药,可选择相对分子质量相对较大的LMWH,避免出现LMWH的体内积聚及产生不良反应,以减轻肾脏负担,并严密监测肾功能。对于出现严重肾功能损害者,应考虑药物体内蓄积,必要时停用LMWH,用其他对肾功能影响小的抗凝药替代。
5、过敏反应
由于LMWH属于动物来源的多组分混合物,过敏是LMWH常见不良反应,常见的有皮肤瘙痒、皮疹、荨麻疹、局部红肿等[76]。上海交通大学医学院附属仁济医院研究妊娠期使用LMWH后瘙痒的发生率,结果显示达肝素6.6%、依诺肝素9.7%、那曲肝素30.9%;皮疹发生率,达肝素4.4%、依诺肝素0%、那曲肝素4.6%;局部红肿发生率,达肝素2.2%、依诺肝素1.8%、那曲肝素13.8%;硬结发生率,达肝素13.3%、依诺肝素20.3%、那曲肝素42.1%[76]。罕见的有急性喉头水肿、过敏性休克等。国际上曾有使用肝素导致患者过敏甚至死亡的报告。
因此,临床上使用肝素类抗凝剂应严格掌握适应证,使用过程中应加以监测,不同LMWH之间不能轻易替换。根据过敏严重程度,给予相应的处理。必要时用非肝素类抗凝药替代抗凝[76]。
6. 其他有关问题
(1) 绒毛膜下血肿
绒毛膜下血肿是滋养细胞部分脱离蜕膜引起的出血,血液积聚在绒毛膜与蜕膜之间形成血肿,可伴或不伴阴道流血等先兆流产症状。其发生率为0.46%~22%[81],在有先兆流产症状患者中发生率约30.5%[82]。迄今为止,绒毛膜下血肿病因主要包括自身免疫因素及凝血功能异常、内分泌因素、辅助生殖技术、感染等[83-85]。研究结果表明绒毛膜下血肿较小时妊娠结局良好,不增加流产的风险[86]。RSA患者治疗过程中如发现绒毛膜下血肿,应根据血肿大小、部位、阴道流血量及持续时间、患者血红蛋白水平、凝血功能、胎儿生长发育等情况进行综合判断。
在辅助生殖助孕患者中,有阴道流血及腹痛症状的患者较无症状患者流产率增加(0.62%比0.12%,P<0.001)[87-88]。根据超声下血肿与绒毛膜囊周长比,可分为大(>2/3)、中(1/3~2/3)和小血肿(<1/3),流产率相应为18.8%、9.2%和7.7%[89]。研究显示,计算血肿体积与孕囊体积比可提示妊娠丢失风险(曲线下面积=0.660),以25%、50%为截断值,妊娠丢失风险逐渐增加[90]。当出现绒毛膜下血肿时,停用ASA,监测抗Xa活性,必要时使用磺达肝癸钠替代LMWH。查找出血原因,针对病因治疗。调整用药后止血或血肿缩小消除的患者,需重新评估能否继续原方案治疗(推荐等级B,证据等级3a)。
(2)注射部位瘀斑
注射部位瘀斑可能由于凝血功能下降或注射操作不当导致。应检查患者的凝血功能,并对患者进行宣教,指导注射LMWH的正确方法。
七、常见RSA抗血栓治疗推荐方案
1、获得性和遗传性PTS[1,91-92]
(1)RSA合并抗磷脂抗体(antiphospholipid antibody,APL)阳性
① LDA单独给药:单纯 APL阳性患者。
② LDA 联合预防剂量LMWH:合并典型APS者,建议计划受孕当月月经干净开始给予预防剂量LMWH,全孕期用药到分娩前24~48 h停药,分娩后12~24 h继续给药至少至产后2周,期间可根据D-二聚体水平调节 LMWH 用量。
③ LDA联合治疗剂量LMWH:适用于既往有动静脉血栓史的APS患者,建议计划受孕当月月经干净后使用LDA联合治疗剂量的LMWH,全孕期用药至分娩前24~48 h停药,分娩后12~24 h继续给药至少至产后6周(推荐级别D,证据水平5)。
④ 联合使用糖皮质激素、免疫抑制剂和免疫调节剂:适用于继发性抗磷脂综合征(secondary antiphospholipid syndrome,SAPS),与风湿免疫科共同管理。原发性抗磷脂综合征(primary antiphospholipid syndrome,PAPS)患者不需要以上药物治疗。
⑤ 若妊娠期间发生VTE合并APS的RSA患者,使用治疗剂量 LMWH,与血管外科、心胸外科等多学科管理,给药至产后6~12周或更长时间(依据血栓情况决定 )。
(2)RSA合并PTS
① 对于近期有VTE表现但未妊娠、合并PTS的RSA患者治愈后6个月方可再次妊娠(推荐级别D,证据水平5)。
② 预防剂量LMWH:适用于无VTE史或近期无VTE表现的RSA患者,从确诊妊娠开始,全孕期用药至分娩前24~48 h停药,分娩后12~24 h继续给药至少至产后2周。但妊娠期间血浆D-二聚体水平明显增加时,可根据D-二聚体水平适当调整 LMWH的使用剂量。
③ 治疗剂量LMWH:对于有VTE 或有VTE家族史患者、对妊娠期间发生 VTE者从确诊妊娠开始,全孕期用药至分娩前24~48 h停药,分娩后12~24 h继续给药至少至产后6周,并根据血栓形成部位与血管外科、心胸外科等多学科共同管理。
(3)RSA合并HHcy:推荐常规使用LDA单独或联合使用LMWH,同时补充叶酸、维生素B族等药物以降低血清Hcy水平。建议将血清Hcy水平降到正常范围后再计划妊娠。
2、合并自身免疫疾病(autoimmune diseases,AID)
(1)合并SLE:使用LDA或联合使用LMWH,并进行妊娠风险评估。具体治疗方案如下。
① LDA单独给药:适用于所有RSA合并SLE患者,计划妊娠当月即开始使用 LDA,持续用药直至妊娠36周或计划分娩前1周(推荐级别B,证据水平2b)。APL阴性且无高危因素的SLE患者,在妊娠晚期给予预防剂量的LMWH。
② LDA联合预防剂量LMWH:适用于APL持续中/高滴度阳性但无VTE病史/家族史和近期无VTE临床表现、具有高危因素者(SLE活动期、SLE肾炎活动期、高血压或服用≥10~20 mg/d 泼尼松等)、APL阴性但合并肾病综合征、APL阴性且无高危因素但单用LDA仍发生妊娠不良事件者,应当计划妊娠,并从备孕当月月经干净开始给药,直至整个孕期(分娩前24~48 h停药),分娩后12~24 h继续给药至少至产后 2~6周。
③ LDA联合治疗剂量:适用于SLE合并APL持续中/高滴度阳性且有VTE病史/家族史、合并具有高危因素但非APS诊断标准临床症状、合并既往联合使用LDA和预防剂量LMWH仍然发生不良妊娠事件且无高危因素但妊娠期发生VTE者,从计划妊娠当月月经干净开始给药或确诊妊娠开始,用药持续整个孕期(分娩前24~48 h停药),分娩后12~24 h继续给药至少至产后2~6 周,妊娠期发生VTE者需多学科共同管理,治疗至产后6~12周甚至更长时间。
(2)合并干燥综合征(Sjogren's syndrome,SS):对合并原发性SS的RSA患者,不建议常规使用LMWH;对继发于SLE、APS等的SS患者,则按照 SLE、APS 选择LMWH给药方案。
(3)合并UCTD:妊娠期根据凝血指标确认是否给予LMWH及适时调整 LMWH 剂量。LDA 联合预防剂量 LMWH适用于APL阳性尚未达到APS诊断标准且既往单用LDA发生妊娠不良事件的UCTD患者从确诊妊娠开始用药,全孕期用药至分娩前24~48 h停药,分娩后12~24 h继续给药至少至产后2 周。
3、其他类型
(1)URSA 患者:目前尚无足够的临床研究证据表明LMWH治疗URSA有效[93]。
(2)反复生化妊娠:发病原因类似于RSA,治疗方案可参照RSA诊治规范。先进行严格病因筛查,根据病因决定是否进行抗凝治疗。
小结
综上,本共识从抗血栓药物类型、特性、药理机制方面深入分析,对临床医生面对RSA患者如何合理地选择抗血栓药物及抗血栓治疗介入的时间、药物用法、效果监测、药物不良反应及用药方案的调整等方面进行全面的梳理及归纳,同时推荐临床上常见的抗血栓治疗方案,完善了RSA抗血栓药物使用规范和共识。该领域临床应用循证依据尚不够充分,有待所有的临床医师在未来临床实践中共同努力,为规范RSA患者抗血栓药物治疗提供更多临床实践参考证据。
专家组
执笔专家(按姓氏拼音排序)
陈慧(中山大学孙逸仙纪念医院)、董梅(广东省妇幼保健院)、冯莹(广州医科大学附属第二医院)、李豫峰(华中科技大学附属同济医院)、王海燕(北京大学第三医院)、张弘(苏州大学附属第二医院)、钟兴明(广东省生殖医院)
共识编写专家组成员(按姓氏汉语拼音排序):
鲍时华(上海市第一妇婴保健院)、曹云霞(安徽医科大学附属第一医院)、陈耀龙(兰州大学循证医学中心)、陈子江(山东大学附属生殖医院)、崔金全(郑州大学附属第二医院)、刁红录(湖北医药学院附属人民医院)、杜美蓉(复旦大学附属妇产科医院)、冯云(云南省第一人民医院)、高玉平(同济大学附属第十人民医院)、胡振兴(徐州医科大学附属徐州妇幼保健院)、黄官友(贵州医科大学附属第一医院)、黄元华(海南医学院附属第一医院)、蒋军松(广西河池市妇幼保健院)、金莉萍(上海市第一妇婴保健院)、康晓敏(云南省第一人民医院)、李大金(复旦大学附属妇产科医院)、李淑萍(南京中医药大学附属常州中医医院)、李蓉(北京大学第三医院)、廖爱华(华中科技大学同济医学院)、刘嘉茵(江苏省人民医院)、刘建荣(山西省人民医院)、罗克燕(遵义医科大学附属医院)、吕良敬(上海交通大学医学院附属仁济医院)、马黔红(四川大学华西第二医院)、马延敏(首都医科大学附属北京妇产医院)、漆洪波(重庆医科大学附属第一医院)、乔宠(中国医科大学盛京医院)、秦朗(四川大学华西第二医院)、谭季春(中国医科大学盛京医院)、王华(湖南省儿童医院)、王俊利(右江民族医学院检验学院)、王琼(中山大学附属第一医院)、王玮(河北医科大学第二医院)、王文娟(上海交通大学医学院附属新华医院)、韦相才(广东省妇幼保健院)、肖青(中山大学附属第八医院)、颜军昊(山东大学附属生殖医院)、杨菁(武汉大学人民医院)、尹建蓝(中山大学附属第七医院)、张翠莲(河南省人民医院)、张丹(浙江大学医学院附属妇产科医院)、张建平(中山大学孙逸仙纪念医院)、张松英(浙江大学医学院附属邵逸夫医院)、张秀泉(南方医科大学顺德医院)、赵爱民(上海交通大学医学院附属仁济医院)、郑鹏生(西安交通大学附属第一医院)、钟依平(中山大学附属第一医院)、周红(广西壮族自治区妇幼保健院)
参考文献:略











 2020
2020