Y. Song1, S. Huang1, X. Zhou1, Y. Jiang1, Q. Qi1, X. Bian1, J. Zhang2, Y. Yan2, D.S. Cram2*, J.Liu1*
1.北京协和医院妇产科
2.北京贝瑞和康生物技术有限公司
通讯作者:刘俊涛,北京协和医院妇产科
摘要:
关键词:妊娠早期 胎儿染色体非整倍体 胎儿DNA片段 孕妇体重 早孕期 无创产前检测
目的:检测212名8–12孕周孕妇血浆样本用以评价无创产前检测(NIPT)在早孕期检测的可行性。
方法:参与本研究的高危孕妇来自同一家医院,运用大规模平行测序检测母体血浆DNA,确定胎儿是否存在21号、18号、13号、X和Y染色体的非整倍体。所有孕妇均需经绒毛膜取样或羊水穿刺,并通过核型分析确认其NIPT结果。跟踪所有NIPT阴性孕妇至分娩,新生儿随访对可能出现的染色体疾病进行临床评估。
结果:NIPT检测出了包括T21(n=2)、T18(n=1)、T13(n=1)在内的常染色体非整倍体,并经核型分析验证。存在一例45,X假阳性和两例47,XXY和45X[16]/47,XXX[14]假阴性。平均血浆DNA含量为8.54%,胎儿游离DNA含量从8周至12周逐渐递增。绝大多数孕妇(95%)血浆中胎儿游离DNA含量超过NIPT的检测下限4%。早孕期胎儿DNA含量与孕妇体重存在轻微的负相关(R2 = 0.186)。
结论:NIPT用于8-12孕周的早孕期检测仍有很高的可靠性和准确性。
背景
无创产前检测(NIPT)运用大规模平行测序检测胎儿游离DNA,现已作为孕妇常规产前保健用于多个国家1,2。前瞻性临床研究结果显示3-5,NIPT高度可靠,对T21、T18、T13三种常见的染色体综合征灵敏度和特异性超过99%,但是性染色体非整倍体(SCAs)的假阳性率和假阴性率却很高。双胎消失综合征(vanishing twin)、DNA含量过低或操作失误可以部分解释SCAs假阳性或假阴性1,不过胎盘嵌合6-10和母体染色体异常11才是导致NIPT结果不符的常见原因。
目前,用于NIPT的母血浆样本通常从10孕周至整个中孕期取样1。在这一妊娠期间,胎盘向母体循环释放胎儿游离DNA片段,其含量在10孕周至21孕周维持在10-20%7,12,13。同一孕周的胎儿游离DNA含量往往差异很大7,14,表明不同孕妇之间显著的生理差异。许多因素会影响胎儿游离DNA含量,其中孕周、孕妇体重和胚胎数量1,12,15影响最为显著。
已报道的前瞻性临床研究3证实,NIPT在检测中孕期胎儿染色体非整倍体方面具有很高的敏感度和特异性。如果将NIPT扩展到早孕期应用,就需证实NIPT在早孕期具有同等的可靠性和精确性。本前瞻性临床研究共招募212名具有胎儿染色体非整倍体高风险孕妇,以评判NIPT在早孕期8-12孕周的检测效果。
方法
试验设计
本研究随机招募213名高龄(>35岁)单胎孕妇(图1)。实验设计经北京协和医院(PUMCH)伦理审查委员会批准,所有受试者均充分知情。采用Streck管采集8-12孕周的血液样本,每一样本配以唯一条码。孕周通过末次月经计算,并于孕7-8周时超声进一步确认。受试者和样本的详细临床信息均被记录在数据库中。绒毛膜取样或羊水穿刺用于产前诊断确诊。NIPT和侵入性产前诊断均对受试者免费,分别在贝瑞和康和协和医院进行双盲检测。所有NIPT阴性孕妇均最终分娩,并由协和医院儿科医师对新生儿进行染色体疾病相关表型的临床评估。
侵入性产前诊断
胎儿细胞样本来自于绒毛膜取样(11W-13W+6)或羊水穿刺(18W-21W+6)。随后细胞培养,分辨率320条带的G显带技术分析至少20个细胞。
非侵入性产前检测
制备母血浆DNA样本,构建文库并添加序列标签,在illumina Hiseq2000平台上完成测序,并用已发表文献中的方法进行数据分析3,16。每个NIPT样本产生5M的36bp序列数据,其中约3.5M数据可唯一比对到人类基因组图谱。Z-值(-3 < Z < 3为正常值)用于判断胎儿24条染色体的非整倍体状况。NIPT阳性样本均经测序检测母血白细胞(WBC)的拷贝数变异状况11,以排除阳性来自于母体嵌合的可能。根据正常男性血浆样本中Y染色体比例与怀有正常男性胎儿孕妇血浆中的Y染色体比例的百分比,来计算孕妇血浆中男性胎儿的DNA含量14。如早先报道17,通过计算待测样本和参考样本之间胎儿DNA异常染色体的比例来判断是否存在染色体非整倍体。
结果
2012年5月至2013年8月,共213名>35岁的孕妇同意在北京协和医院参与本研究(图1)。孕妇平均体重为60.02 ± 8.83 kg (范围在 41.2-98.0 kg),采样时孕周范围为8周-12周+6。试验选择的212名孕妇中,42名(19.8%)有流产史,13名(6.1%)通过辅助生殖受孕。在收集完213名孕妇血液样本并进行NIPT后,34名孕妇由于担心流产或感染风险而拒绝绒毛膜取样或羊水穿刺。在这34名孕妇中,8名(23.5%)有流产史,3名(8.8%)为辅助生殖受孕。213份样本中有1份由于红细胞溶解而未通过QC,后该孕妇未再参与本研究,因此最终参与本研究的为212人。212名孕妇进而分为两个亚组,较大的一组由178名孕妇组成(组A),她们同时接受NIPT和侵入性产前诊断,较小的一组由34名只接受了NIPT的孕妇组成(组B)(图1)。

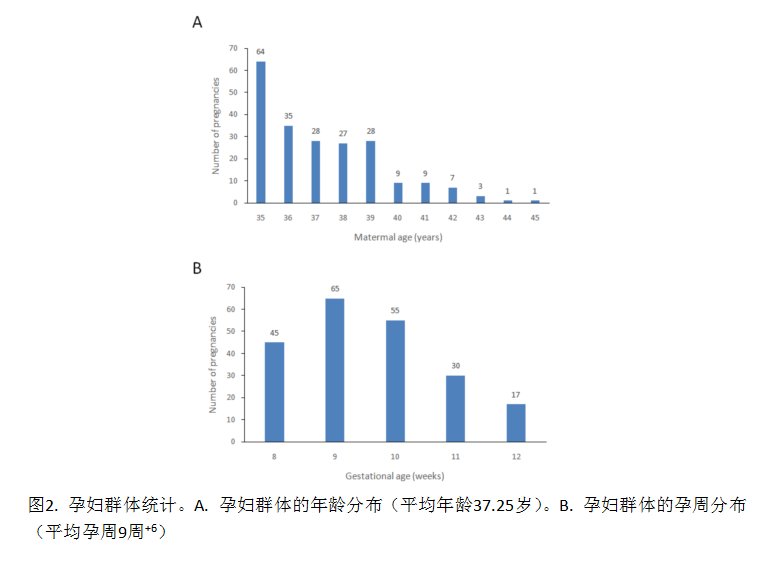
接受NIPT检测的212名孕妇年龄分布和孕周分布见图2a和图2b。孕妇平均年龄为37.25岁(年龄范围为35-45岁),其中182名(85.8%)女性小于40岁。NIPT样本均来自于早孕期,平均孕周为9周+6( 孕周范围为8周-12周+6)。但212份样本中的110份来自更早的8周-9周+6孕周。
组A的178份样本检测出5例胎儿染色体非整倍体(表1),包括T21 (n=2)、 T18 (n=1),、T13 (n=1) 和45,X(n=1)。随后的侵入性产前诊断证实了4例三体综合征,但1例NIPT结果为45,X的样本被证实为正常的46,XX核型。此外,2例被NIPT检测为正常的胎儿经侵入性产前诊断证实为47,XXY 和45,XX[16]/47,XXX[14]。因此,NIPT对性染色体非整倍体存在1例假阳性(0.56%)和2例假阴性(1.12%)。对NIPT检测不符的3例性染色体非整倍体(SCAs)进行母血浆白细胞测序(WBCs),确定母亲为正常的46,XX核型,表明NIPT结果为胎儿特异。所有6名怀有染色体非整倍体胎儿的孕妇选择了终止妊娠。其余172名阴性孕妇继续妊娠,在北京协和医院或其相关医院分娩,儿科医师对172名新生儿进行染色体综合征的检查,排除了新生儿患病的可能。侵入性产前诊断和新生儿检查表明,NIPT对三体综合征的检测高度准确,灵敏度 (95% CI)为T21 100% (19.79-100%) 、T18 100% (5.46-100%)、T13 100% (5.46-100%)。特异性(95% CI)为T21 100% (97.35-100%)、T18 100% (97.35-100%) 、T13 100% (97.35-100%)。NIPT对性染色体检测的特异性 (95% CI)为 99.43% (96.39-99.97%)。
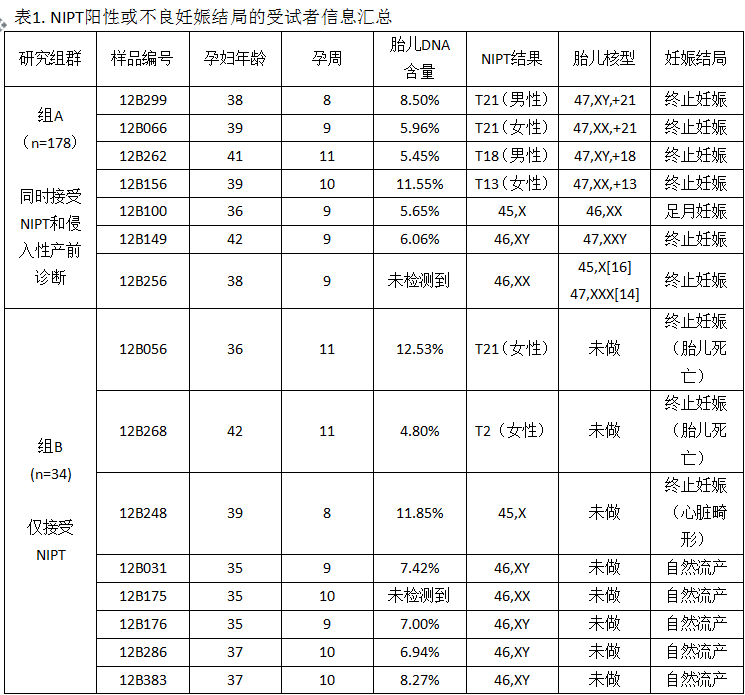
在拒绝进行产前诊断的34名孕妇(组B)中,NIPT检测到3例染色体非整倍体,分别为T21、45,X和T2(表 1)。由于胎儿死亡或存在明显的心脏异常,孕妇选择了终止妊娠。另有5名孕妇在NIPT取样后的1-2周发生了自然流产。遗憾的是,发生自然流产的孕妇未在协和医院留下记录,因此没有相应的流产组织来证实NIPT结果。其余26名NIPT正常的孕妇顺利分娩,并由儿科医生对新生儿进行检查,排除了其患有染色体综合征的可能。
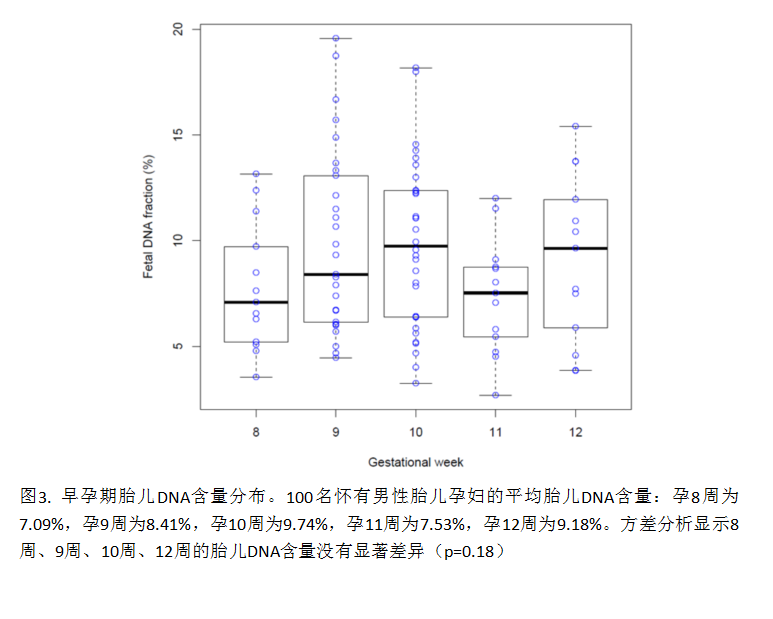
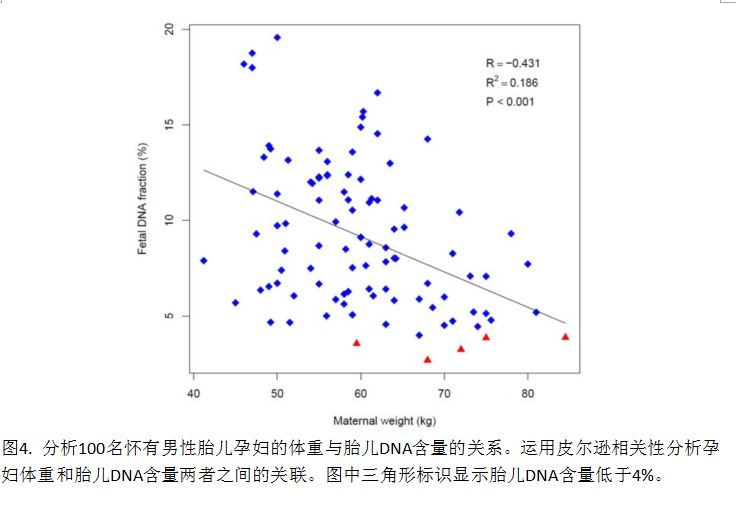
我们对100份(47.2%)怀有男性胎儿的孕妇血浆样本(图 3)进行二次分析,以确认胎儿游离DNA含量与早期孕周的关系。8-12孕周的平均胎儿DNA含量为8.54%,广泛的分布在2.69% - 18.75%。从8周到12周,胎儿游离DNA含量呈现轻微的上升,但8周、9周、10周和12周的胎儿DNA含量方差分析没有显著性差异(p=0.18)。具有重要临床意义的是,100份样本中有5份(5%)胎儿游离DNA含量低于4%(检测染色体非整倍体的切割值),其孕周分别为8周+1、10周、 11周+1、12周+4和12周+6。100份样本的胎儿DNA含量与孕妇体重(图4)呈负相关(R2 值为 0.186 (p < 0.001))。5份胎儿DNA含量低于4%的样本,孕妇体重均高于群体平均值。
讨论
在对212名孕妇胎儿染色体非整倍体的初步研究中,评估了NIPT用于早孕期的检测效果。178名孕妇同时接受了NIPT和侵入性产前诊断,34名孕妇只接受了NIPT。基于178份的NIPT、产前诊断以及新生儿随访结果,NIPT检测T21、T18和T13没有出现假阳性和假阴性。不过NIPT另有1例SCA假阳性和2例SCAs假阴性,假阳性率和假阴性率分别为0.56%和1.12%。总体来看,本项针对早孕期高危人群的NIPT研究,取得了与近期报道的1741例中国孕妇、1982例广东孕妇和1914例美国孕妇4的三个前瞻性试验相一致的检测灵敏度和特异性,不过这三个试验的血液样本均采集于中孕期。
为了解释3例与核型分析不一致的NIPT结果,我们对所有NIPT结果和临床数据进行了回顾。45,X假阳性案例中的胎儿DNA含量为较低的5.65%,但仍足够进行精确的NIPT检测。推测这例NIPT不一致是由45,X限制性胎盘嵌合(CPM)造成,此现象在最近一篇47,XXX的案例中报道过10。遗憾的是,婴儿出生后我们没有得到相关的胎儿组织进行验证。47,XXY假阴性孕妇通过IVF移植两个未知性别的胚胎而受孕,尽管6.06%的胎儿DNA含量相对较低,但NIPT未检出的原因可能是双胎消失的男性胎儿对胎儿游离DNA含量额外贡献了46,XY序列,这有效的中和了本应从存活的47,XXY胎儿中获得的额外X染色体片段。孕7周β-hCG检测为64659mIU/ml,这一水平与消失的双胎水平接近18,这也支持了上述假设。此外,孕7周的超声显示存在两个孕囊和一个胎心,这也意味着存在一个未能存活的胎儿。第二例NIPT假阴性的胎儿核型为45,X[16]/47,XXX [14]嵌合体,进入血液循环的X染色体片段被相对等量的45,X和47,XXX所中和,故NIPT得出正常女性的结论。尽管如此,这样的极端案例表明NIPT不能全部检出实际为嵌合体的胎儿。
大部分的T21、T18和T13三体综合征的胎儿会在早孕期死亡,表现为自然流产19。34名没有接受侵入性产前诊断的孕妇群体中,NIPT检测到T21、T2和45,X三个阳性胎儿,其胎儿游离DNA含量分别为12.53%、4.8% 和11.85%。根据临床记录,T21和T2两个胎儿在NIPT取样后几天就停止了发育,45,X的胎儿继续发育但却出现严重的心脏畸形。这三个案例中的胎儿都进行了人工流产,但并未保留胎儿流产组织验证NIPT结果。同时此组另有5例NIPT阴性的胎儿发生了自然流产,这5例样本的胎儿DNA含量在6.94-8.27%之间。由此8个案例可发现,无论是胎儿生长停滞还是自然流产都不是导致胎儿游离DNA含量低于检测极限4%的原因。
在对100名男性胎儿的研究中发现,8-12孕周平均胎儿DNA含量为8.54%,5%样本的胎儿DNA含量低于4%检测切割值。有趣的是,我们发现在8周、9周、10周和12孕周胎儿游离DNA含量未呈现显著变化。这意味着在这4个孕周内,胎儿DNA含量只轻微增加。相比之下,孕11-14周进行的广东籍孕妇NIPT研究14中,平均胎儿游离DNA含量为14.5%。结合这些研究,推测胎儿游离DNA含量在早孕期结束时开始稳定上升。这与之前报道的中孕期胎儿DNA含量为10-21%并每周增加1%7,13的结论相符合。在早孕期,我们还发现了胎儿游离DNA含量减少与母亲体重增加的微弱关系(R2 =0.186, p<0.001)。在类似的195例11-14孕周男性胎儿的样本研究中,也观察到类似的胎儿游离DNA含量与母亲体重关系趋势(R2 =0.16, p<0.01) 14。总之,本研究数据显示,为确保NIPT在早孕期检验的有效性,应尽量保证胎儿游离DNA含量大于4%,而母体体重过高则不适于进行NIPT。
综上所述,我们发现NIPT可适用于8-12孕周的早孕期孕妇,但体重偏高的孕妇适用性有待进一步证实。值得注意的是,约有5%的孕妇胎儿游离DNA含量低于4%的检测极限,在此极限之下NIPT无法检出三体综合征。因此,在将NIPT引入早孕期的临床实践之前应当进一步提高其敏感性和特异性以便NIPT可有效的应用于所有样本。最新研究显示20,深度测序产生约20M片段数时,可以检出3%胎儿游离DNA含量时的三体综合征。如果这一发现可以在更低的胎儿DNA含量水平上复制,那么随着测序成本的降低,通过增加测序深度将NIPT用于早孕期便可以实现。
REFERENCES
1. Benn P, Cuckle H, Pergament E. Non-invasive prenatal testing for aneuploidy:current status and future prospects. Ultrasound Obstet Gynecol 2013; 42: 15-33.
2. Musci TJ, Fairbrother G, Batey A, Bruursema J, Struble C, Song K. Non-invasive prenatal testing with cell-free DNA: US physician attitudes toward implementation in clinical practice. Prenat Diagn 2013; 33: 424-428.
3. Song Y, Liu C, Qi H, Zhang Y, Bian X, Liu J. Non invasive prenatal testing of fetal aneuploidies by massively parallel sequencing in a prospective Chinese population. Prenat Diagn 2013; 33: 700-706.
4. Bianchi DW, Parker RL, Wentworth J, Madankumar R, Saffer C, Das AF, Craig JA, Chudova DI, Devers PL, Jones KW, Oliver K, Rava RP, Sehnert AJ; CARE StudyGroup. DNA sequencing versus standard prenatal aneuploidy screening. New Engl J Med 2014; 370: 799-808.
5. T. K. Lau, S. W. Cheung, P. S. S. Lo, A. N. Pursley, M. K. Chan, F. Jiang, H. Zhang,W. Wang, L. F. J. Jong, O. K. C. Yuen, H. Y. C. Chan, W. S. K. Chan and K. W.Choy. Non-invasive prenatal testing for fetal chromosomal abnormalities bylow-coverage whole-genome sequencing of maternal plasma DNA: review of 1982 consecutive cases in a single center. Ultrasound Obstet Gynecol 2014; 43:254-264.
6. Wang Y, Zhu J, Chen Y, Lu S, Chen B, Zhao X, Wu Y, Han X, Ma D, Liu Z, Cram D,Cheng W. Two cases of placental T21 mosaicism: challenging the detectionlimits of non-invasive prenatal testing. Prenat Diagn 2013; 33: 1207-1210.
7. Canick JA, Palomaki GE, Kloza EM, Lambert-Messerlian GM, Haddow JE. The impact of maternal plasma DNA fetal fraction on next generation sequencing tests for common fetal aneuploidies. Prenat Diagn 2013; 33: 667-676.
8. Hall AL, Drendel HM, Verbrugge JL, Reese AM, Schumacher KL, Griffith CB,Weaver DD, Abernathy MP, Litton CG, Vance GH. Positive cell-free fetal DNA testing for trisomy 13 reveals confined placental mosaicism. Genet Med 2013;15: 729-732.
9. Grati FR, Malvestiti F, Ferreira JC, Bajaj K, Gaetani E, Agrati C, Grimi B, Dulcetti F, Ruggeri AM, De Toffol S, Maggi F, Wapner R, Gross S, Simoni G. Fetoplacental mosaicism: potential implications for false-positive and false-negative noninvasive prenatal screening results. Genet Med 2014; Feb 13. doi:10.1038/gim.2014.3.
10. Gao Y, Stejskai D, Jiang F, Wang W. False-negative trisomy 18 non-invasive prenatal test result due to 48,XXX,+18 placental mosaicism. Ultrasound Obstet Gynecol 2014; 43: 477-478.
11. Wang Y, Chen Y, Tian F, Zhang J, Song Z, Wu Y, Han X, Hu W, Ma D, Cram D, Cheng W. Maternal mosaicism is a significant contributor to discordant sex chromosomal aneuploidies associated with noninvasive prenatal testing. Clin Chem 2014; 60: 251-259.
12. Wang E, Batey A, Struble C, Musci T, Song K, Oliphant A. Gestational age and maternal weight effects on fetal cell-free DNA in maternal plasma. Prenat Diagn 2013; 33: 662-666.
13. Taglauer ES, Wilkins-Haug L, Bianchi DW. Review: Cell-free fetal DNA in the maternal circulation as an indication of placental health and disease. Placenta 2014; 35 Suppl: 64-68.
14. Hudecova I, Sahota D, Heung MM, Jin Y, Lee WS, Leung TY, Lo YM, Chiu RW. Maternal plasma fetal DNA fractions in pregnancies with high and low risks for fetal chromosome aneuploidies. PLoS One 2014; 9: e88484.
15. Qu JZ, Leung TY, Jiang P, Liao GJ, Cheng YK, Sun H, Chiu RW, Chan KC, Lo YM. Noninvasive prenatal determination of twin zygosity by maternal plasma DNAanalysis. Clin Chem 2013; 59: 427-435.
16. Liang D, Lv W, Wang H, Xu L, Liu J, Li H, Hu L, Peng Y, Wu L. Non-invasive prenatal testing of fetal whole chromosome aneuploidy by massively parallel sequencing. Prenat Diagn 2013; 33: 409-415.
17. Fan HC, Blumenfeld YJ, Chitkara U, Hudgins L, Quake SR. Noninvasive diagnosis of fetal aneuploidy by shotgun sequencing DNA from maternal blood. Proc Natl Acad Sci USA 2008; 105: 16266-16271.
18. Poikkeus P, Hiilesmaa V, Tiitinen A. Serum HCG 12 days after embryo transfer in predicting pregnancy outcome. Hum Reprod 2002; 17: 1901-5.
19. Hassold T, Hunt P. To err (meiotically) is human: genesis of human aneuploidy. Nat Rev Genet 2001; 2: 280-291.
20. Benn P, Cuckle, H. Theoretical performance of non-invasive prenatal testing for chromosome imbalances using counting of cell-free DNA fragments in maternal plasma. Prenat Diagn. 2014; Mar 27. doi: 10.1002/pd.4366.











 2020
2020